تولید ترکیبات نامتعارف نمک طعام با تخطی از قوانین شیمی

شیمیدانان در کمال شگفتی متوجه شدهاند که تحت شرایطی ویژه، ساختار شیمیایی نمک طعام میتواند اشکالی محیرالعقول و خلاف قوانین عرف واکنشهای شیمیایی بگیرد.
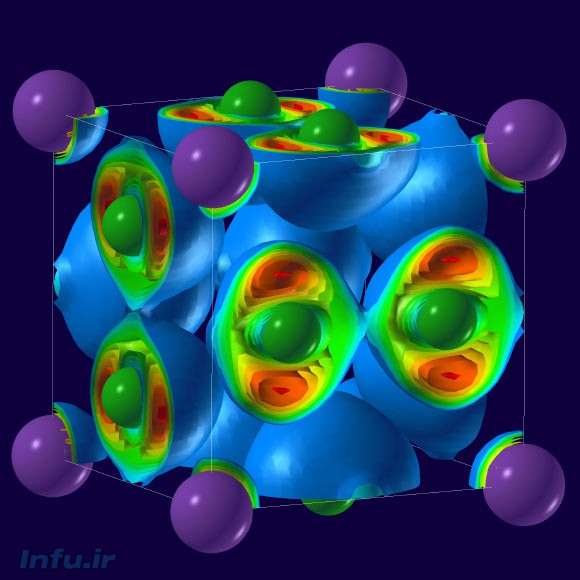
NaCl به ترکیبات باثبات دیگری نظیر Na3Cl، Na2Cl، Na3Cl2، و حتی NaCl7 هم بدل شده که جملگیشان از پیوندهای شیمیایی و خواص الکترونی کاملاً متفاوتی پدید آمدهاند. این دانشمندان که در ابتدا الگوریتمهای تازهای را بهمنظور تعریف سلسلهای جدید از ساختارهای شیمیایی احتمالی ناشی از اعمال فشار بر سنگ نمک (و یا همان نمک طعام، با فرمول شیمیایی NaCl) استفاده کرده بودند، درصدد برآمدند الگوهای بهدستآمده را به کمک سندانی از جنس الماس، و از طریق اختلاط کلر مولکولی و سدیم فلزی تحت فشارهای بالا بهوجود آورند. “ما فهمیدیم که قوانین عرف شیمی تحت چنین شرایطی شکسته خواهد شد”؛ این را دکتر الکساندر گونچاروف، از محققین انیستیتو کارنگی واشنگتن میگوید که در تهیه گزارش نهایی این یافته – که در نشریه Science منتشر شده – هم دست داشته است.
طبق کتب درسی رشته شیمی، عناصر سدیم و کلر الکترونگاتیویهای کاملاً متفاوتی دارند و لذا در صورت واکنش، یک ترکیب یونی را با ساختاری مشخص حاصل میکنند. بار سدیم ۱+ است، و بار کلر ۱-؛ و این بدینمعناست که طی واکنش، سدیم یک الکترون میدهد و کلر یک الکترون میگیرد. با این حساب، تنها ترکیب ممکن از این دو عنصر، حالت ۱:۱ است؛ یعنی همان NaCl.
اما بهگفته دکتر ویووی ژانگ، از شیمیدانان دانشگاه استونیبروک نیویورک، “ما به ترکیبات محیرالعقولی رسیدیم که قوانین کتب شیمی را نقض میکنند – ترکیباتی مثل NaCl3، NaCl7، Na3Cl2، Na2Cl، و Na3Cl”. او در اینباره توضیح میدهد که: “این ترکیبات از لحاظ ترمودینامیکی هم پایدارند و چنانچه تولید شوند، به ثبات میرسند و دیگر هیچ عاملی از هم نمیپاشدشان. شیمی کلاسیک حتی وجود ترکیباتی را هم منکر میشود. شیمی کلاسیک همچنین میگوید که اتمها خواهان پیروی از قاعده «هشتتایی»اند – یعنی عناصر طوری تبادل الکترون میکنند تا چیدمان نهاییشان بیشترین شباهت ممکن را به چیدمان الکترونهای نزدیکترین گاز نجیبشان در جدول تناوبی ثمر بدهد؛ بهطوریکه بیرونیترین قشر الکترونیشان کامل و باثبات بماند. خب حالا چنین قانونی شکسته شده”.
اگر این ترکیب نمک طعام بتواند تحت شرایط پرفشار به چنین ترکیبات متنوعی بدل شود، احتمالاً سایر ترکیبات شیمیایی هم بتوانند. این مسأله به ما کمک میکند تا بتوانیم به سؤالات تعیینکنندهای راجع به هستههای اولیه سیارات، و همچنین نحوه تولید مواد کاربردی جدید هم پاسخ بدهیم.
NaCl به ترکیبات باثبات دیگری نظیر Na3Cl، Na2Cl، Na3Cl2، و حتی NaCl7 هم بدل شده که جملگیشان از پیوندهای شیمیایی و خواص الکترونی کاملاً متفاوتی پدید آمدهاند. ساختار نامتعارف این ترکیبات، از طریق روش بدیع پیشبینی ساختار بلورها که توسط یکی از پژوهشگران حاضر در این بررسی، یعنی پروفسور آرتم اوگانوف از دانشگاه استونیبروک ابداع شده، استنباط شده است؛ روشی که بهاختصار، USPEX (مخفف «پیشبینیگر سازههای همهمنظوره: بلورشناسی فرگشتی») نامیده میشود و رویهمرفته واژهای روسی به معنای «موفقیت» را میسازد که اصطلاح مرسومی بین بلورشناسان و متخصصین علوم مواد است.
این ترکیبات محیرالعقول نهتنها سطح درکمان از ترکیبات شیمیایی را وسعت بخشیدهاند، بلکه بعید نیست که در آینده بتوان از آنها نتایج کاربردی هم گرفت. مثلاً ترکیبات NaCl7، NaCl3، NaCl2، و Na2Cl، از نوع فلزیاند (که این مسأله، ظاهراً علت تخطی این ترکیبات از قوانین الکترونخنثایی را هم توجیه میکند، چراکه این قوانین بر روی فلزات صدق نمیکنند)، و حتی یکی از حالات نیمههادی ترکیب NaCl3 تحت فشارهایی مابین ۲۵۰ تا ۴۸۰ هزار اتمسفر هم دوام میآورد.
بهگفته پروفسور اوگانوف، “Na3Cl ساختار جذابی دارد و متشکل از چند لایه NaCl و چند لایه سدیم خالص است. لایههای NaCl مثل عایق عمل میکنند، و لایههای سدیم خالص هم رسانا هستند. ترکیبات اینچنینی با رسانایی دوبعدی، هواخواه زیادی دارند”.
گونچاروف نیز اضافه میکند: “اگر این ترکیب ساده [یعنی نمک طعام] بتواند تحت شرایط پرفشار به چنین ترکیبات متنوعی بدل شود، احتمالاً سایر ترکیبات شیمیایی هم بتوانند. این مسأله به ما کمک میکند تا بتوانیم به سؤالات تعیینکنندهای راجع به هستههای اولیه سیارات، و همچنین نحوه تولید مواد کاربردی جدید هم پاسخ بدهیم”.
منبع: Sci-News